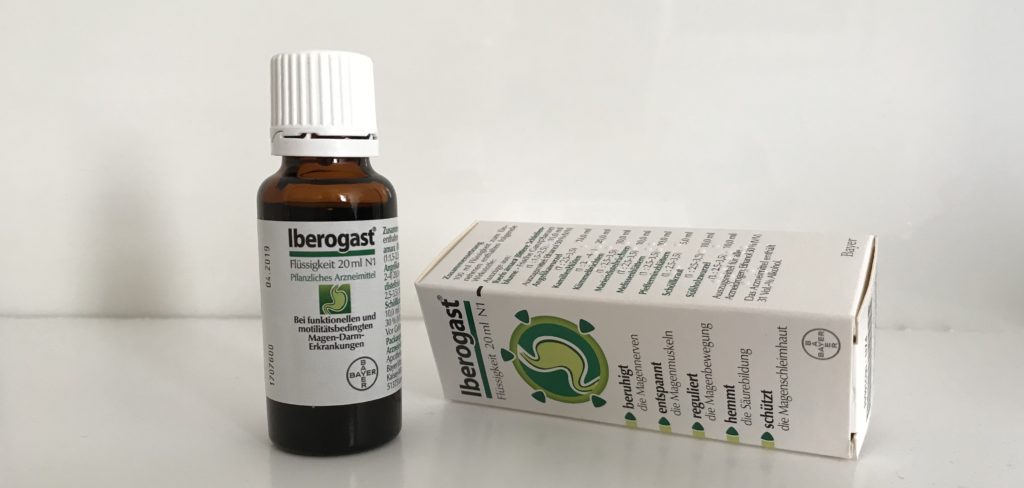
Die Schweiz hat sie, Deutschland nicht. Die Rede ist von zusätzlichen Warnhinweisen auf dem BeipackzettelBeipackzettel Fertigarzneimittel dürfen ausschließlich zusammen mit einer Packungsbeilage ausgeliefert werden. Das Arzneimittelgesetz (AMG) gibt vor, wie der Beipackzettel eines Medikaments gestaltet sein muss. Es muss die vorgegebenen Angaben in festgelegter Reihenfolge beinhalten. Dazu gehören unter anderem der Name des Medikamentes, Anwendungsbereiche, Gegenanzeichen, Vorsichtsmaßnahmen und Wechselwirkungen mit anderen Medikamenten, Dosierung und Nebenwirkungen. Der Beipackzettel ist in erster Linie für die Anwender des Medikamentes verfasst. Damit dieser für Menschen ohne Fachwissen verständlich ist, durchlaufen Beipackzettel einen Lesbarkeitstest. Sie werden z.B. durch das BfArM oder das PEI geprüft und genehmigt, bevor sie in den Umlauf kommen. des Magenmittels IberogastIberogast Iberogast® ist ein pflanzliches Arzneimittel des Pharmaunternehmens Bayer gegen Magen-Darm-Beschwerden. Iberogast® Classic beinhält Schöllkraut, eine Pflanzenart aus der Familie der Mohngewächse. Bei hoher Dosierung und längerer Anwendungsdauer kann Schöllkraut die Leber schädigen. Das Bundesinstitut für Arzneimittel forderte bereits 2008 den damaligen Hersteller auf, über das Leberrisiko dieses Präparates im Beipackzettel aufzuklären. Nach langem Ringen und einem Todesfall im Jahr 2018 nahm Bayer einen entsprechenden Warnhinweis in den Beipackzettel auf. Seit Ende 2020 bietet Bayer eine Schöllkrautfreie Variante an (Iberogast® Advance).. Die Firma BayerBayer Bayer ist ein Chemie- und Pharmakonzern mit Sitz in Leverkusen. Bei den meisten Produkten, die das Unternehmen produziert, handelt es sich um Medikamente; hauptsächlich für Menschen, aber auch für Tiere. Zudem vertreibt es Nahrungsergänzungsmittel, Fußpflege-Produkte und Sonnencremes. Für die Landwirtschaft entwickelt Bayer Saatgut und Pflanzenschutzmittel. Wegen des Unkrautvernichters Roundup steht der Konzern immer wieder vor Gericht. verkauft ihren Topseller hierzulande immer noch ohne zusätzlichen Vermerk auf seltene Nebenwirkungen, die das Bundesinstitut für ArzneimittelArzneimittel Arzneimittel sind Stoffe oder Zubereitungen aus Stoffen, die angewandt werden, um Krankheiten, Leiden, Körperschäden oder Beschwerden zu heilen, zu lindern oder zu verhüten. Es kann sich hierbei ebenfalls um Mittel handeln, die dafür sorgen, dass Krankheiten oder Beschwerden gar nicht erst auftreten. Die Definition beinhaltet ebenso Substanzen, die der Diagnose einer Krankheit nutzen oder seelische Zustände beeinflussen. Die Mittel können dabei im Körper oder auch am Körper wirken. Das gilt sowohl für die Anwendung beim Menschen als auch beim Tier. Die gesetzliche Definition von Arzneimitteln ist im § 2 Arzneimittelgesetz (AMG) enthalten. (BfArMBfArM Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) ist zuständig für die Zulassung und Registrierung von Arzneimitteln, Arzneimittelsicherheit (Pharmakovigilanz) sowie für die Risikoerfassung und -bewertung von Medizinprodukten. Es regelt sowohl das legale Inverkehrbringen von Betäubungsmitteln und ihren Ausgangsstoffen als auch deren Herstellung, Anbau und Handel. Das BfArM agiert ebenso dafür Forschung und regulierende Tätigkeiten miteinander zu vernetzen.) eigentlich verlangt. Iberogast gehört laut einem Bericht der FAZ zu den Umsatzträgern des Pharmakonzerns, im vergangenen Jahr setzten Apotheken damit mehr als 120 Millionen Euro um. MedWatch, das arznei-telegramm, Spiegel online und auch Zeit Online berichteten über die Hintergründe.
Braucht es in Deutschland eine Gesetzesänderung?
Von Seiten der Politik nahm sich Kordula Schulz-AscheKordula Schulz-Asche Kordula Schulz-Asche, Kommunikationswissenschaftlerin und Gründungsmitglied des heutigen Bündnis 90/Die Grünen ist Mitglied des Deutschen Bundestages. Nach langjähriger Arbeit für Entwicklungsorganisationen in Afrika war sie für das GIZ-Projekt „HIV/AIDS-Bekämpfung in Entwicklungsländern“ tätig. Kordula Schulz-Asche ist (Stand 2022) unter anderem Mitglied der Deutschen Afrika Stiftung, Ehrenamtliches Beiratsmitglied bei der Gesellschaft für Recht und Politik im Gesundheitswesen e.V., des Gesundheitsausschusses sowie des Unterausschusses Globale Gesundheit sowie stellvertretendes Mitglied des Familienausschusses., grüne Bundestagsabgeordnete, dem Fall an. Nach mehreren Anfragen an die Bundesregierung brachte sie im April das Thema in den GesundheitsausschussGesundheitsausschuss Der Gesundheitsausschuss entwickelt auf nationaler und EU-Ebene die Reformen der gesetzlichen Krankenkassen. Patientenrechte, ärztliche Belange, ethische Fragen der Medizin sowie Arzneimittelversorgung und -sicherheit gehören ebenso zu seinen Aufgabengebieten. Im Bereich der Krankenversicherungen beschäftigt sich der Gesundheitsausschuss mit dem Leistungs- und Beitragsrecht und kümmert sich zudem um die Rechte der Vertragsärzte sowie Verbände und vieles mehr. Der Gesundheitsausschluss kann ausschließlich Beschlussempfehlungen abgeben, die Sitzungen sind nicht öffentlich. des Deutschen Bundestags ein. Ergebnis seitens der Bundesregierung: Es bleibt alles beim Alten.
Doch wie MedWatch erfuhr, arbeitet Schulz-Asche derzeit bereits an einem Gesetzentwurf. Er soll den §28 im Arzneimittelgesetz ergänzen, damit Bescheide des BfArM über die Aufnahme von Warnhinweisen und Kennzeichnungen der Arzneimittelverpackung fortan regelmäßig per sofortigem Vollzug durchzusetzen sind. So sollen Widersprüche von Herstellern „keine aufschiebende Wirkung mehr entfalten“, heißt es aus dem Abgeordnetenbüro.
Was ist ein sofortiger Vollzug?
Grundsätzlich haben der Widerspruch und eine Klage gegenüber einem Verwaltungsakt eine aufschiebende Wirkung. Damit ist gemeint, dass die Behörde, die einen Verwaltungsakt beschlossen hat, diesen nicht vollziehen kann, solange über den eingelegten Widerspruch oder die Klage nicht entschieden wurde. Mit Hilfe der in der Verwaltungsgerichtsordnung (§ 80 I S.1 VwGO) gesetzlich angeordneten aufschiebenden Wirkung kann der sogenannte Adressat eines belastenden Verwaltungsaktes erst einmal die Rechtmäßigkeit prüfen lassen, ohne dass er eine Vollstreckung durch die Behörde befürchten muss.
Diese aufschiebende Wirkung der gegen einen belastenden Verwaltungsakt entfällt, sobald der anzufechtende Verwaltungsakt sofort zu vollziehen ist. Unter „sofort vollziehbar“ versteht man also solche Verwaltungsakte, gegen die eingelegte Rechtsbehelfe keine aufschiebende Wirkung haben. Sobald ein Verwaltungsakt „sofort vollziehbar“ ist, gibt es keine aufschiebende Wirkung.
Was besagt Paragraph 28?
Im Arzneimittelgesetz ist die sogenannte Auflagebefugnis geregelt. Demnach kann die zuständige Bundesoberbehörde die Zulassung eines Arzneimittels mit Auflagen verbinden. Festgeschrieben ist, dass Auflagen auch nachträglich angeordnet werden können. Paragraph 28 besagt zudem, wann das BfArM welche Auflagen und Warnhinweise anordnen kann, „um bei der Anwendung des Arzneimittels eine unmittelbare oder mittelbare Gefährdung der Gesundheit von Mensch oder Tier zu verhüten“.
Was sagt das BfArM zu dem Vorstoß?
Kein Kommentar. Das BfArM wiederholt, was es schon immer erklärt hat, und verweist auf das laufende Verfahren.
Man kann der Behörde durchaus vorwerfen, sie habe im Fall Iberogast zu zögerlich reagiert. Aber für die Mitarbeiter hat sich die Situation wohl anders dargestellt, wie Spiegel Online im Februar 2018 berichtete. Als das BfArM 2008 den Stufenplan zu SchöllkrautSchöllkraut Schöllkraut, eine Pflanzenart aus der Familie der Mohngewächse, ist in Iberogast® Classic enthalten; ein pflanzliches Arzneimittel des Pharmaunternehmens Bayer gegen Magen-Darm-Beschwerden. Bei hoher Dosierung und längerer Anwendungsdauer kann Schöllkraut die Leber schädigen. Das Bundesinstitut für Arzneimittel forderte bereits 2008 den damaligen Hersteller auf, über das Leberrisiko dieses Präparates im Beipackzettel aufzuklären. Nach langem Ringen und einem Todesfall im Jahr 2018 nahm Bayer einen entsprechenden Warnhinweis in den Beipackzettel auf. Seit Ende 2020 bietet Bayer eine Schöllkrautfreie Variante an (Iberogast® Advance). verabschiedete – das auch in Iberogast enthalten ist – haben der Bundesbehörde zwar 48 Fallberichte aus Deutschland vorgelegen, bei denen ein Zusammenhang zwischen Leberschäden und schöllkrauthaltigen Präparaten vermutet wurde. gewesen, berichtete Spiegel Online:
Statt den Widerspruch (Anmerk d. Red.: des Pharmaherstellers Bayer) zu akzeptieren oder abzuweisen, sammelte die Behörde weiter Meldungen von Patienten und Ärzten, die nach der Einnahme von Schöllkraut unter Leberproblemen litten. Knapp zehn Jahre später, im Sommer 2017, traute sich das BfArM endlich: die Behörde wies den Widerspruch gegen die Warnhinweise zurück, Bayer klagte. Jetzt liegt der Fall beim Verwaltungsgericht Köln. Statt den Experten in der Behörde werden Richter darüber entscheiden, wie gefährlich das Medikament wirklich ist.
Zeigt sich am Fall Iberogast die ungesunde Seite des Gesundheitssystems?
Das BfArM sammelte also Schadensmeldungen, bevor es trotz bereits erfolgten Prüfung aktiv wurde. Anders formuliert: Es mussten erst Menschen durch Iberogast die gefährlichen Nebenwirkungen melden, bevor die Behörde gegen Pharmahersteller Bayer auftreten wollte – um vor ihnen zu warnen.
Jörg Heynemann wundert das wenig. Der Medizinrechtler aus Berlin und Mitglied im MedWatch-Beirat nennt die Behörde einen zahnlosen Tiger. „Die Auflagen in Paragraph 28 fallen alle in den Bereich der Ermessensentscheidungen“, sagt er. Das BfArM hätte also längst handeln können. Dass das BfArM in einem Prozess gegen Bayer zu einem früheren Zeitpunkt hätte verlieren können, ist für Heynemann kein Argument, nicht zu handeln. Dann scheitert man eben. Schon in anderen Fällen hat er die zögerliche Vorgehensweise des Instituts bemängelt. „Die oberste Aufgabe muss es doch sein, den Patienten zu schützen“, sagt Heynemann. Die nun erwägte mögliche Änderung in Paragraph 28, die dem Haus ein starkes Instrument in die Hand geben würde, sei zu begrüßen: Dadurch komme das BfArM mehr unter Druck, wirklich etwas zu tun.
Hinweis der Redaktion: Die Aussage, dass es erst weitere Fälle von Nebenwirkungsmeldungen zu Iberogast brauchte, war missverständlich formuliert. Wir haben dies korrigiert. (08.06.18)